Contact Chercheur
Camille Locht
Directeur de recherche Inserm
Unité 1019 Inserm/CNRS, Centre d’infection et d’immunité de Lille
Équipe Recherche sur les mycobactéries et les bordetelles
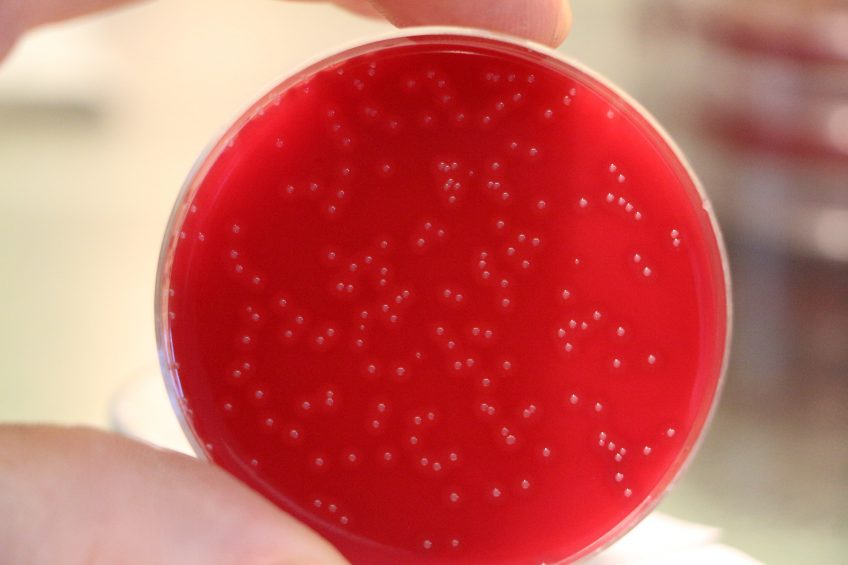
Colonies de Bordetella pertussis, agent de la coqueluche, sur une boîte d’agar. © Camille Locht/Inserm
Hautement infectieuse et potentiellement mortelle chez le nourrisson, la coqueluche, causée par la bactérie Bordetella pertussis, continue de circuler largement à travers le monde. En effet, si les vaccins utilisés actuellement protègent contre l’apparition des symptômes, ils ne permettent pas d’empêcher la transmission bactérienne entre individus, ni l’infection qui en résulte. Une équipe de recherche internationale dirigée par Camille Locht, directeur de recherche Inserm au sein du Centre d’infection et d’immunité de Lille (Inserm/Institut Pasteur de Lille/Université de Lille/CHU de Lille/CNRS), vient de montrer, dans un essai clinique de phase 2, l’efficacité et la sûreté chez l’adulte d’un nouveau vaccin nasal contre la coqueluche. Ses résultats, à paraître dans The Lancet, suggèrent que ce nouveau vaccin, capable d’empêcher la colonisation bactérienne des voies respiratoires, constituerait un atout pertinent pour briser les chaînes de transmission épidémiques de la maladie.
La coqueluche est une maladie infectieuse respiratoire provoquée par la bactérie Bordetella pertussis. Très contagieuse, elle est connue pour générer des complications mortelles chez le nourrisson.
Depuis la fin des années 1990, le vaccin dCaT[1] est majoritairement utilisé pour lutter contre la coqueluche, mais l’immunité qu’il confère diminue avec le temps, nécessitant des rappels. En outre, s’il permet de prévenir l’apparition des symptômes, il ne peut pas prévenir l’infection par la bactérie en elle-même ni sa transmission entre individus. Ainsi, malgré les taux élevés de vaccination, les épidémies de coqueluche persistent partout dans le monde.
Le développement d’un nouveau vaccin anticoquelucheux, appelé BPZE1, a pour objectif de palier les défauts du vaccin dCaT pour mieux lutter contre ces épidémies. Ce vaccin dit « vivant atténué » (contenant une version atténuée de la bactérie) a pour particularité de s’administrer par voie nasale et ainsi de mimer les modes de transmission et de colonisation naturels de Bordetella pertussis au niveau des muqueuses des voies respiratoires.
Une équipe de recherche internationale dirigée par Camille Locht, directeur de recherche Inserm au sein du Centre d’infection et d’immunité de Lille (Inserm/Institut Pasteur de Lille/Université de Lille/CHU de Lille/CNRS), en collaboration avec la société ILiAD Biotechnologies, a travaillé à l’évaluation de l’efficacité et de l’innocuité (non-toxicité) du vaccin BPZE1 au sein d’un essai clinique de phase 2 portant sur 300 Américains adultes en bonne santé.
Dans un premier temps, les participants ont été répartis en 2 groupes : le premier a reçu une dose de BPZE1 par voie nasale et un placebo par voie intramusculaire, le second une injection en intramusculaire du vaccin dCaT et un placebo par voie nasale. Trois mois plus tard, la moitié des participants de chacun des deux groupes s’est vue administrer une dose de BPZE1 (afin de simuler une infection naturelle de manière atténuée), tandis que l’autre moitié a reçu le placebo intranasal.
L’équipe de recherche a constaté que, là où le vaccin dCaT n’induisait une sécrétion de marqueurs de l’immunité contre Bordetella pertussis qu’au niveau sanguin, BPZE1, lui, induisait une immunité consistante au niveau de la muqueuse nasale en plus de l’immunité sanguine. Par ailleurs, dans les 28 jours suivant la seconde administration par voie nasale, 90 % des participants ayant initialement reçu BPZE1 ne présentaient aucune colonie bactérienne au niveau nasal. Chez les 10 % restants, la colonisation s’avérait faible (moins de 260 colonies par mL de mucus). En comparaison, 70 % des patients vaccinés avec dCaT présentaient une colonisation bactérienne nasale importante (près de 14 325 colonies par mL).
Par ailleurs, l’infection régressait plus rapidement chez les personnes vaccinées avec BPZE1 et l’équipe de recherche n’a constaté aucun effet secondaire notable dû à la vaccination pendant la durée de l’étude.
Ainsi, selon Camille Locht, « le profil bénéfice/risque du vaccin BPZE1 est favorable : une seule administration nasale permet d’induire sans danger et avec une bonne tolérance, une immunité forte et durable, tant au niveau sanguin qu’au niveau des voies respiratoires. En outre, contrairement au vaccin dCaT, BPZE1 protège les muqueuses d’une colonisation par la bactérie. »
Bordetella pertussis infectant les voies respiratoires et se multipliant dans leurs muqueuses, une immunité à ce niveau pourrait en effet être essentielle dans la prévention des épidémies de coqueluche.
« Cette bactérie étant hautement infectieuse pour l’être humain, il est critique qu’un vaccin ne cible pas uniquement le développement de la maladie mais également la transmission de la bactérie qui la cause et la vitesse à laquelle l’organisme se débarrasse de cette dernière, ajoute Camille Locht. Dans cette optique, BPZE1 apparaît comme un nouvel outil pertinent pour prévenir les infections de coqueluche et réduire les chaînes de transmission épidémiques. »
Les participants à cette étude étant tous des adultes de plus de 18 ans, une étude est en cours pour évaluer plus spécifiquement l’efficacité et l’innocuité de BPZE1 chez les enfants en âge d’aller à l’école, lieu critique de transmission de la maladie.
En 2008, le projet européen Child-Innovac est lancé sous l’égide de l’Inserm en collaboration avec 10 partenaires européens, avec pour objectif de développer un vaccin nasal innovant contre la coqueluche. C’est dans ce cadre que le vaccin BPZE1 sera développé et breveté par une équipe de l’Inserm et de l’institut Pasteur de Lille dirigée par Camille Locht, directeur de recherche Inserm et coordinateur du projet. En 2014, l’équipe de recherche publie dans la revue PLOS One les premiers travaux d’évaluation de l’efficacité et de l’innocuité du vaccin BPZE1 dans un essai clinique de phase 1, après examen des données par un comité indépendant (Independant Data Monitoring Commitee). Un accord est alors conclu entre la plateforme Inserm Transfert, en charge de la valorisation de la propriété intellectuelle liée à la technologie BPZE, et la société ILiAD Biotechnologies, afin de poursuivre le développement et l’évaluation du vaccin. En 2020, de nouveaux travaux de phase 1 dirigés par Camille Locht, cette fois en collaboration avec ILiAD Biotechnologies, et publiés dans The Lancet Infectious Diseases, sont venus renforcer les résultats cliniques de 2014 sur la sécurité et l’efficacité du vaccin
[1] Le vaccin dCaT est dit « acellulaire », c’est-à-dire qu’il ne contient pas de bactéries complètes mais uniquement certaines protéines issues de Bordetella pertussis qui ont la particularité de déclencher une réponse immunitaire sanguine. Il combine les vaccins contre la coqueluche, la diphtérie, la poliomyélite et le tétanos. Il est administré en 3 doses intramusculaires chez le nourrisson à 2, 4 et 11 mois. 3 rappels sont recommandés à environ 16 mois, 11 ans et 26 ans. Mieux toléré, il est cependant plus cher et moins efficace que le vaccin cellulaire (ou à « germe entier », c’est-à-dire qui contient la bactérie inactivée) qui est encore utilisé aujourd’hui dans de nombreux pays en développement.
Camille Locht
Directeur de recherche Inserm
Unité 1019 Inserm/CNRS, Centre d’infection et d’immunité de Lille
Équipe Recherche sur les mycobactéries et les bordetelles
Immunogenicity and safety of BPZE1, an intranasal live attenuated pertussis vaccine, versus tetanus–diphtheria– acellular pertussis vaccine: a randomised, double-blind, phase 2b trial
Cheryl Keech, MD1, Vicki E. Miller, MD2, Barbara Rizzardi, MD3, Christopher Hoyle, MBA4, Melinda J. Pryor, PhD5, Jonathan Ferrand, PhD5, Ken Solovay, MS1, Marcel Thalen, PhD1,6, Stephanie Noviello, MD1, Peter Goldstein, MS1, Andrew Gorringe, PhD7, Breeze Cavell, PhD7, Qiushui He, MD8, Alex-Mikael Barkoff, MSc8, Keith Rubin, MD1, Camille Locht, PhD9
1 ILiAD Biotechnologies, LLC, Weston, FL USA
2 DM Clinical Research, Texas Center for Drug Development, Houston, TX USA
3 Velocity Clinical Research, West Jordan, UT USA
4 Elite Research Network, Mount Pleasant, SC USA
5 360biolabs, Melbourne Victoria, Australia
6 BioLyo Technologies, BVBA, Ghent, Belgium
7 United Kingdom Health Security Agency, Porton Down, Salisbury UK
8 University of Turku, Institute of Biomedicine, Turku Finland
9 University Lille, CNRS, Inserm, CHU Lille, Institut Pasteur de Lille, U1019-UMR9017–CIIL – Centre for Infection and Immunity of Lille, Lille, France
The Lancet, 10 mars 2023
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(22)02644-7/fulltext