Clinique
L’expression clinique est limitée au dermatome correspondant au ganglion sensitif, dans lequel a lieu la réactivation du virus. Les lésions du zona persistent en général deux à trois semaines chez des sujets immunocompétents.
Les localisations les plus fréquentes sont thoraciques (56%), céphaliques (14%), cervicales (11,5%), lombaires (12%), sacrées (4,5%) et ophtalmiques (5%).
Les douleurs de la phase aiguë et les douleurs post-zostériennes s’observent dans les territoires concernés.
Épidémiologie
Situation en France
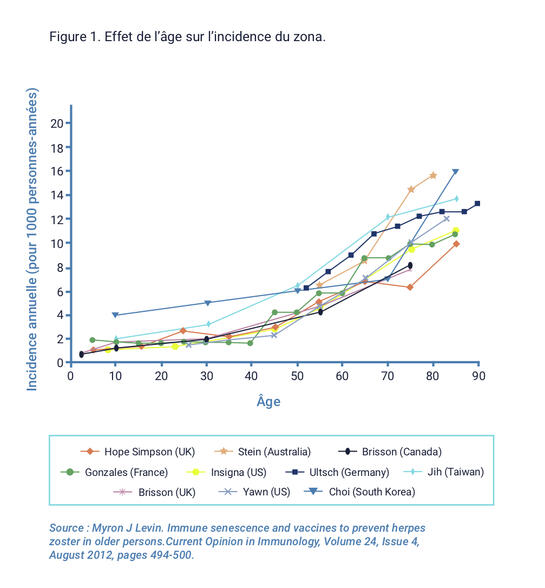
En France, on observe 1,3 à 5 cas de zona pour 1000, et 5 à 10 cas pour 1000 chez les plus de 60 ans. Au cours de la vie, 20% de la population pourraient avoir au moins un zona.
La surveillance en France est réalisée, depuis 2004, par le réseau Sentinelles de l’Inserm dont les médecins-vigies comptabilisent les premières consultations pour zona en phase aiguë. L’incidence de ces consultations est de 3,9 cas pour 1000 habitants, soit environ 235000 cas annuels, dont 7% de zonas ophtalmiques. L’âge médian est de 58 ans. Le taux d’incidence est de 2 pour 1000 chez les moins de 50 ans [IC 95% : 0,8-3,1], de 5,6 pour 1000 de 50 à 69 ans [IC 95% : 2,0-9,2] et de 10,7 pour 1000 chez les plus de 69 ans [IC 95% : 4,1-10,4].
69% des patients reçoivent un traitement antiviral oral, 5% un traitement par voie locale mais, d’une manière générale, 1/5 des prescriptions d’antiviraux est fait après 60 ans.
Le nombre de zonas en établissements d’hébergement pour personnes âgées dépendantes (Ehpad), recevant 600000 patients, est de 6000 à 6500 par an avec une incidence de 8,9 pour 1000 lits par an. En stratifiant par tranches d’âge après 50 ans, on observe globalement 21% des cas de 50 à 69 ans et 44% des cas à 70 ans et plus.
Situation à l’étranger
Aux États-Unis, on évaluait le nombre de zonas à 4,05 cas pour 1000 en 1992 et à 3,71 cas pour 1000 en 2002. En 2004, on a dénombré 555000 cas de zona par an, avec 69600 cas de douleurs post-zostériennes.
En Grande-Bretagne, tous âges confondus, on recense 1,3 à 8,4 cas pour 1000, soit environ 250000 cas annuels.
Télécharger et imprimer la figure
Épidémiologie des douleurs liées au zona
À côté des douleurs de la phase aiguë, il existe des douleurs persistantes. Elles s’observent dans 30,5% des cas si l’on utilise un critère de durée de trente jours, 17,6% des cas pour une durée de soixante jours, et 12,5% des cas au-delà de quatre-vingt-dix jours ; il s’agit alors de douleurs post-zostériennes. En fonction de l’âge, on observe ces douleurs dans 5,9% des zonas de 60 à 64 ans, 7,7% de 65 à 69 ans, 15,2% de 70 à 74 ans, et 22% dans les zonas survenant au-delà de 75 ans.
Dans une étude prospective islandaise chez plus de 400 patients, les douleurs persistent trois mois après un zona chez 18% des patients âgés de moins de 60 ans, 12% entre 60 à 69 ans et 28% chez ceux de plus de 70 ans (dans la plupart des cas, les douleurs étaient légères même chez les plus de 70 ans chez lesquels elles n’étaient sévères que dans 2% des cas). Dans cette même étude, la prévalence des douleurs douze mois après un zona est respectivement de 0,7%, 4% et 15% pour chacune des tranches d’âge.
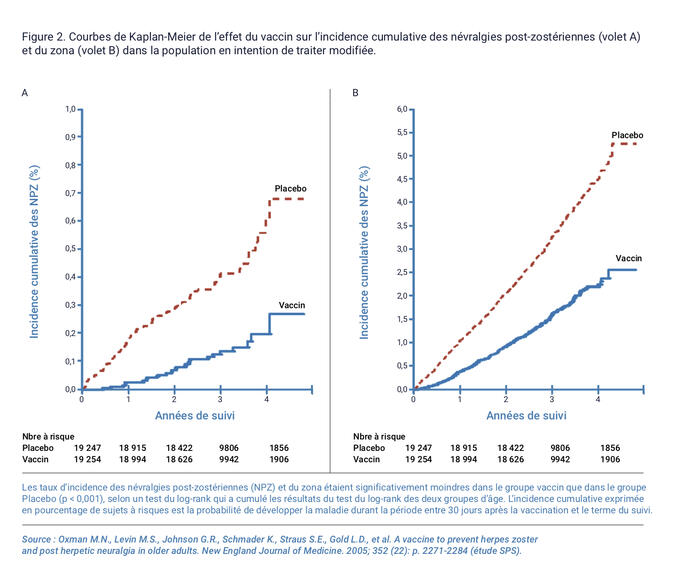
Un traitement antiviral précoce diminue la durée de l'éruption mais n'empêche pas les neuropathies post-zostériennes.